Methylester
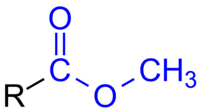
methylester ist R ein Chloratom.


Methylester sind chemische Verbindungen, die zur Gruppe der Ester gehören. Sie entstehen durch Veresterung einer Carbonsäure oder einer anorganischen Oxosäure mit Methanol und weisen die charakteristische funktionelle Estergruppe auf. Neben den Carbonsäureestern zählen zu den Methylestern auch Kohlensäureester und Ester, die sich von Sulfonsäuren und Methanol ableiten. Analog können sich auch aus Salpetersäure, Sulfinsäuren, Phosphonsäuren oder Phosphinsäuren einerseits und Methanol andererseits Methylester bilden.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Carbonsäuremethylester kommen als sogn. Fruchtester in vielen Früchten und Speisen als geruchsgebende Komponente vor.[1] In der Natur kommt Zimtsäuremethylester in verschiedenen Pflanzen vor, z. B. in Erdbeeren und verschiedenen Basilikumarten.[2] Die Eukalyptus-Art Eucalyptus olida hat den größten Gehalt an Zimtsäuremethylester.[3]
Anthranilsäuremethylester kommt natürlich in Kakao, Kaffee, Trauben, Grapefruit, Jasmin, Zitronen, Limetten, Erdbeeren und Mandarinen[4] sowie in vielen Blütenölen (z. B. Neroli-, Ylang-Ylang-Öl) vor.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Methylester entstehen z. B. aus einer Carbonsäure und Methanol unter säurekatalysierter Wasserabspaltung. Aus Carbonsäurechloriden und Methanol können nach der Schotten-Baumann-Methode ebenfalls Methylester erhalten werden. Methyester lassen sich auch aus Carbonsäureanhydriden und Methanol synthetisieren. Die nucleophile Substitution von Methylhalogeniden (z. B. Methyliodid) mit Carboxylat-Ionen liefert ebenso Methylester, wie die Reaktion von Carbonsäuren mit Diazomethan, CH2N2.[5]
Entsprechend bilden sich Dimethylester aus Dicarbonsäuren und Methanol, Trimethylester aus Tricarbonsäuren und Methanol usw.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Einige Methylester von Carbonsäuren werden als Geschmacks- und Aromatastoffe eingesetzt:
- Fruchtaromen:
- Buttersäuremethylester riecht nach Ananas oder Apfel
- Phenylessigsäuremethylester Aroma von Honig
- Gewürzaromen:
- Benzoesäuremethylester riecht nach Niobeöl
Methylester von Fettsäuren (Fettsäuremethylester) werden als Biodiesel oder als Zusatz zum konventionellen Dieselkraftstoff eingesetzt. Um das Rapsöl (Glycerinester langkettiger Fettsäuren) in Biodiesel (FAME, Rapsölmethylester, Sojaölmethylester) umzuwandeln, muss man das Rapsöl umestern, das heißt den Glycerolteil des Esters durch Methanol ersetzen. 4-Hydroxybenzoesäuremethylester (PHB-Ester) wird als Konservierungsmittel E 218 in der Lebensmittelindustrie eingesetzt.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- Ethylester, Carbonsäureester, die sich vom Ethanol ableiten
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner Verlag (2011) S. 85–86, ISBN 978-3-8348-1245-2.
- ↑ Amparo Viña, Elizabeth Murillo: Essential oil composition from twelve varieties of basil (Ocimum spp) grown in Colombia, in: J. Braz. Chem. Soc., 2003, 14 (5); doi:10.1590/S0103-50532003000500008.
- ↑ D. J. Boland, J. J. Brophy, A. P. N. House, Eucalyptus Leaf Oils, 1991, ISBN 0-909605-69-6.
- ↑ Datenblatt Methyl anthranilate, natural (US), ≥ 98 %, FG bei Sigma-Aldrich, abgerufen am 9. April 2012 (PDF).
- ↑ K. Peter C. Vollhardt: Organische Chemie, VCH, Weinheim 1990, ISBN 3-527-26912-6, S. 772.